透過紫外可見光光譜量測葉綠素於食品的分析
前言介紹
葉綠素是一種在植物材料中自然存在的綠色色素。整體結構中包含的高度共軛的卟啉環,使其能夠在紫外可見光譜的紅色區域吸收光能,如圖1所表示。由於能夠到達地球表面的光子跨越可見光到近紅外光譜範圍,並且在約500奈米處有最大光子通量,含有葉綠素等分子的植物能夠吸收更多的入射光子。透過吸收這些光,植物可以進行光合作用,從而為植物提供能量。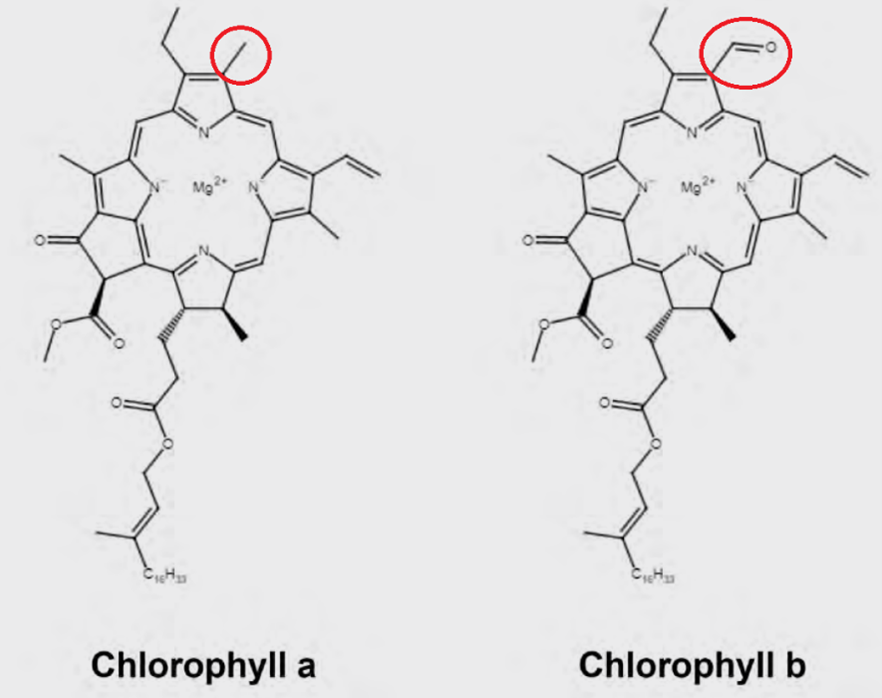
圖1. 葉綠素a與葉綠素b的分子結構
由於許多商業可用的食品產品,內含有植物材料或者源自植物,因此可以觀察到不同濃度的葉綠素。葉綠素是一種綠色色素,因此類似菠菜和萵苣等葉菜類食品自然含有一定濃度的葉綠素。然而,這些化合物也可以在種子和提取的油中找到。在某些食品行業中,確認食品產品中的葉綠素濃度是很重要的。例如,在菜籽油中,葉綠素是一種不受歡迎的污染物,因為它不僅改變了油的顏色,還可能參與到不需要的反應中,降低了油的整體品質。在這些情況下,確定葉綠素含量可能至關重要。
自然界中存在多種不同的葉綠素化合物,食品產品中也有類似的多樣化學結構。例如,葉綠素a和葉綠素b在整體卟啉結構中,僅在其中一個吡咯環上存在甲基和醛基的差異,見圖1紅圈處。此外,pheophytin a與葉綠素a類似,但在卟啉環內不含鎂對離子。
葉綠素a比其他形式的葉綠素更普遍,但在許多不同的來源中可以找到不同比例的葉綠素色素。結構上的微小變化,影響了分子的整體共軛性,導致電子結構的差異,因此材料的吸收性質也不同。因此,這些化合物之間,具有不同的紫外可見光吸收光譜,且為一種非破壞性檢測。因此,可藉此光譜技術,用於檢測和定量給定食品產品中的不同葉綠素衍生物。
在這裡,使用了Thermo Scientific™ Evolution™ Pro 紫外光可見光光譜儀,來分析菠菜樣品中提取的葉綠素,以及分析橄欖油和菜籽油樣品中的葉綠素含量。利用所得到的紫外可見光譜與儀器上測量的葉綠素標準進行了比較,並進行了進一步的數學分析以確定葉綠素a和b的濃度。對於菜籽油,葉綠素濃度是根據美國油脂化學家協會(AOCS)的程序進行量化的。
實驗方法
葉綠素標準品製備
葉綠素a和b(分別為Chl a和Chl b)標準品,分別通過將1.0毫克溶解於0.5毫升95 %乙醇中製備。然後,將每個標準液分別稀釋在二甲基亞碸(DMSO)和80 %水合丙酮中,使吸收極大值接近1.0。根據UV-vis測量,葉綠素a和葉綠素b標準在兩種溶劑中的最終濃度,分別為13.3 μM(12.0毫克/升)和5.0 μM(4.6毫克/升)。這些濃度用於確保樣品的吸光度,在最長波長峰值下低於1.0。在製備和分析標準時,需要在暗室下執行,以防止材料的光降解。菠菜葉綠素萃取物的製備
取一部分的菠菜葉,在2.0毫升80 %丙酮的情況下使用研钵和研杵研磨。然後,將混合物轉移到樣品瓶中,並使用2.0毫升80 %丙酮三次沖洗研钵和研杵。沖洗液也收集到同一個樣品瓶中,總共回收了6.0毫升的菠菜溶液。收集完後,將樣品在Thermo Scientific Sorvall™ ST 16離心機上以2500轉/分的速度,離心10分鐘。然後,倒出溶液以去除殘留的白色/淡綠色固體。使用相同程序再收集了兩次提取物。所用菠菜葉片的重量見表1。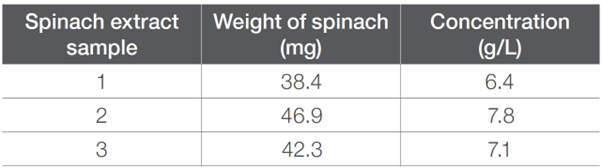
表1. 每個菠菜萃取物樣品的樣品重量和濃度
樣品油於葉綠素分析的製備
選擇了一份橄欖油和一份菜籽油樣品,來進行葉綠素含量分析。這兩個樣品是從當地一家雜貨店購買的,並直接使用。對於確定菜籽油樣品中Chl a的消光系數的實驗中,準備了加入了Chl a標準溶液,其濃度為13.3 μM。每個菜籽油樣品中Chl a的最終濃度,見下表2。對於每個加入了Chl a的菜籽油樣品,收集的吸光度透過減去沒有Chl a的菜籽油的吸收光譜來進行校正。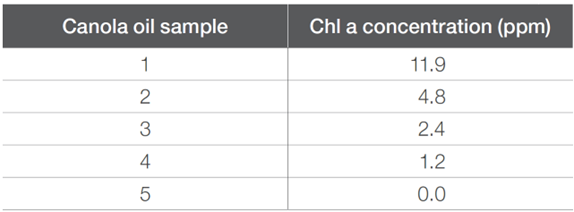
表2. 每菜籽油樣本中標準葉綠素a的濃度
儀器設備與參數
使用Evolution Pro紫外光可見光光譜儀,收集每個樣品溶液的UV-vis光譜。參數為1.0 nm的光譜帶寬和2 nm的數據間隔,光譜範圍為350 nm至800 nm。量測樣品時,使用1.0 cm光徑長的塑料比色皿。另外使用5.0 cm光徑長的石英比色皿。結果與討論
葉綠素標準品
如前所述,使用 Evolution Pro 量測DMSO 和80%丙酮中 Chl a 和 Chl b 標準溶液的 UV-vis 吸收光譜。從肉眼觀察,兩種溶液都呈現綠色。如圖2所示,兩種葉綠素標準的光譜是獨特的,包括多個吸收極大值。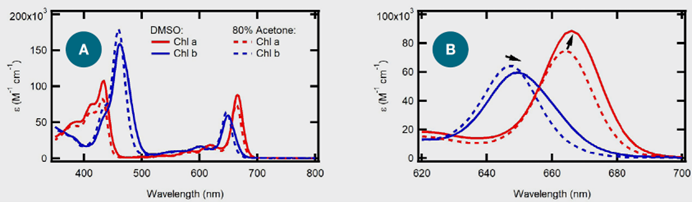
圖2. 葉綠素a與葉綠素b於80 %水合丙酮與DMSO溶液中的光譜表現
在80%丙酮中,Chl a 的明顯吸收帶位於432 nm和664 nm處。在相同的溶劑中,Chl b 在460 nm和647 nm處有強的吸收峰,如表3所示,其結果與文獻相符。在卟啉中,這些帶分別稱為 B 帶和 Q 帶。Chl b 包含一個醛基團,取代了卟啉結構中一個吡咯環上的甲基基團。這種化學結構的變化影響了化合物的整體電子結構,導致了 Chl a 和 Chl b 之間觀察到的光譜差異。當在 DMSO 中分析 Chl a 和 Chl b 時,可以觀察到一些小的光譜變化,這與文獻一致。
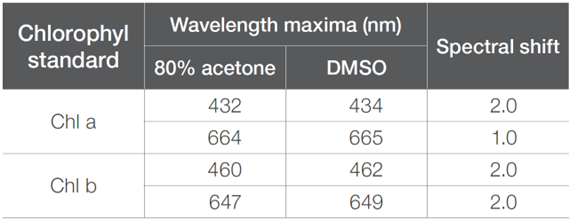
表3. Chl a and Chl b在80%丙酮和二甲基亞碸中觀察到的波長最大值,
以及與溶劑環境變化相關的光譜飄移
首先,對於Chl a和Chl b,當處於較高極性的溶劑中時,吸收峰最大值向紅移(bathochromic)約2.0 nm,如圖2B和表3所呈現。這種溶劑依賴性的移動被稱為溶劑色變,是由於分子的基態或最低能激發態的溶解度不同而引起的,從而改變了電子結構。吸收光譜隨著溶劑極性增加而向紅移,被稱為正溶劑色變,意味著分子在其激發態時比在基態時更極性化,因此更穩定。激發態的穩定會使激發態能量降低得更多,比基態更多,導致基態和激發態之間的能量差更小,對應著較長波長的吸收峰。
其次,Chl a 和 Chl b 的摩爾吸光係數/消光係數(ε)也受到所使用溶劑的影響。隨著溶劑極性的增加,Chl a的ε增加,而 Chl b的ε則降低。ε反映了基態和激發態之間的躍遷概率。較高的ε與電子被提升到激發態的機率較高相關。這意味著當處於更極性的溶劑中時,如DMSO,Chl a的躍遷機率更高。對於Chl b,在溶劑極性增加時,躍遷概率較低。根據比爾定律,濃度(c)與給定路徑長度(l)中的ε成正比,如方程式 1 所示。
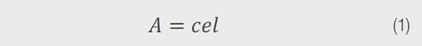
由於峰值位置和ε均受溶劑環境影響,因此在使用比爾定律定量綠葉素樣品時,確保使用正確的ε非常重要。
葉綠素分析—菠菜樣品
如前所述,葉綠素可以在大多數食品樣品中找到,包括菠菜葉。先前已經對菠菜葉進行了葉綠素的檢測和定量分析,結果顯示菠菜葉中含有相當高濃度的葉綠素。因此,菠菜被選為一個模型系統,以展示利用UV-vis光譜學分析食品樣品中葉綠素含量的能力。透過之前概述的程序,從菠菜葉中提取的提取物被收集並使用Evolution Pro光譜儀進行分析。圖3A顯示了來自菠菜提取物的UV-vis光譜。在665 nm和432 nm處發現了明顯的吸收極大值,類似於葉綠素a的吸收光譜。
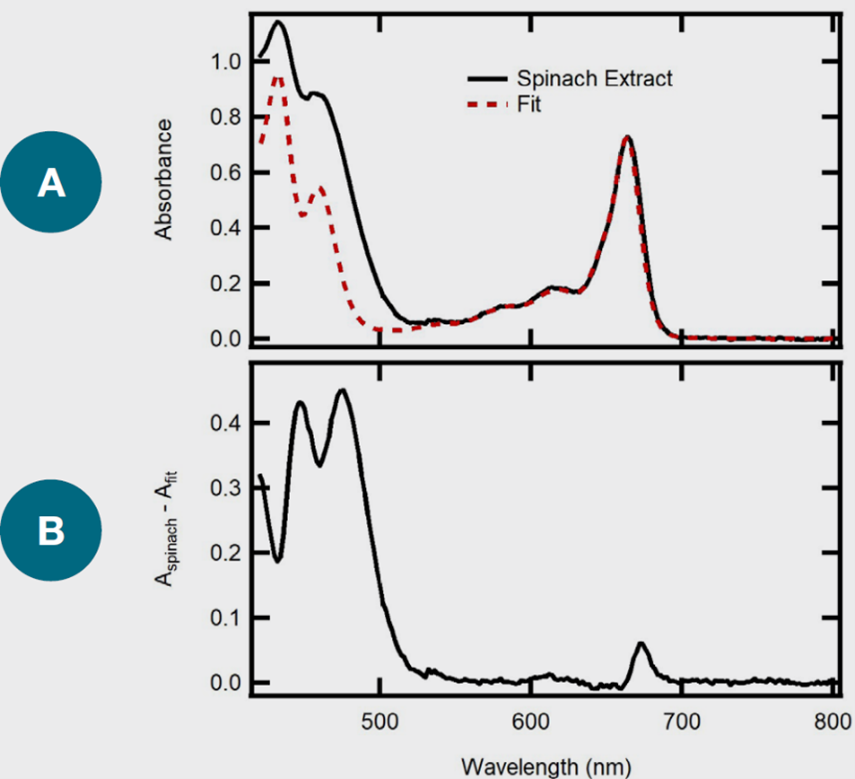
圖3.
(A) 菠菜萃取物黑色光譜和擬合由葉綠素a和b紅色光譜的線性組合組成。
(B) 透過從兩者的擬合值相減後計算出相減的紫外-可見光光譜。
菠菜萃取物的溶劑,以及用於建構擬合的葉綠素 a 和 b 樣品是 80% 丙酮。
然而,提取的葉綠素光譜與葉綠素a的光譜並不完全匹配,暗示存在其他吸收劑。根據文獻,提取的菠菜樣品還含有一定量的葉綠素b,以及其他類似葉綠素的色素(例如:類胡蘿蔔素)。方程式2表示含有多個成分的溶液的吸收譜,可以表示為每個存在成分的吸收的線性組合。
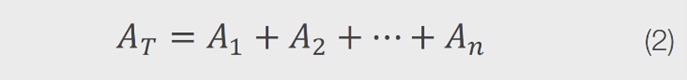
因此,可以使用葉綠素a和葉綠素b譜的線性組合來擬合提取的葉綠素譜,進而確定每個成分的濃度。對於菠菜提取物樣品,收集到的UV-vis光譜被擬合到方程式3中。其中,Aspinach(λ)表示作為波長函數的菠菜提取物的吸收,Achl a(λ)表示作為波長函數的12.0 mg/L葉綠素a標準的吸收,Achl b(λ)表示作為波長函數的4.6 mg/L葉綠素b標準的吸收,而b和c是擬合參數。擬合參數b和c被允許在600至700 nm之間變化,直到擬合譜在此波長範圍內優化。
從擬合中,確定了葉綠素a和葉綠素b的平均濃度,並在表4中進行了報告。由於每個測量樣品在提取過程中使用的菠菜量不同,因此結果已經歸一化,以反應每單位菠菜質量中葉綠素a或b的存在量,如表4所示。
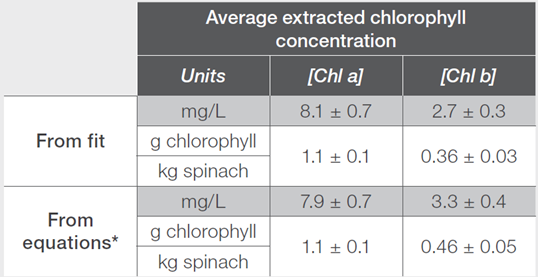
表4. 平均葉綠素a和b濃度以測定擬合程序和文獻方程式
根據文獻,葉綠素a和葉綠素b組分的濃度也可以通過方程式4和5進行估算,其中[Chl a]和[Chl b]分別是Chl a和Chl b的濃度,以μg/L為單位,A664是664 nm處的吸光度,A647是647 nm處的吸光度。這些方程考慮了在分析波長下來自Chl a和Chl b的貢獻,以避免對每個相應的葉綠素色素的真實濃度進行過度估計。如前所述,葉綠素的ε取決於溶劑。
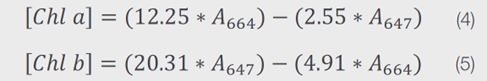
因此,方程式4和5中使用的值,僅適用於分散在80%丙酮中的樣品。上述方程式被用來確定菠菜提取物樣品中Chl a和Chl b的濃度,並返回與透過擬合確定的值相似的值如表4。圖4為這些方程使用Insight Pro軟體進行自動化的畫面,以限制所需的後續測量分析量。
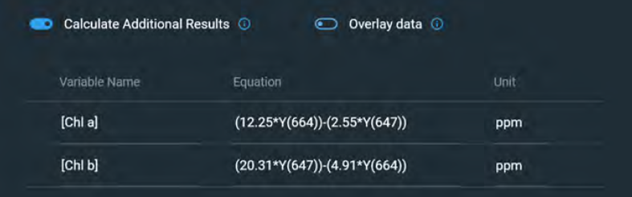
圖4. Insight Pro軟體客製化計算畫面
儘管菠菜提取物在600 nm至700 nm的光譜區域的吸收與擬合函數密切匹配,但在較短波長的吸收方面則不匹配。這個結果意味著,在提取樣品中存在其他成分。為了更好地確定這些額外的吸收劑的身份,通過從測得的UV-Vis光譜中減去擬合函數來收集差異光譜。由於吸收是所有吸收劑的線性組合,因此從測得光譜中去除由Chl a和Chl b引起的吸收,可以用於估算剩餘吸收性化合物的吸收光譜。圖3B包括所獲得的差異光譜,顯著地在448 nm和474 nm處有窄帶。已知類胡蘿蔔素,如β-胡蘿蔔素和葉黃素,會在400 nm至500 nm之間吸收,其最大值接近450 nm和470 nm。然而,這些額外的類胡蘿蔔素的確切識別超出了本研究的範圍,但這些結果表明,從菠菜葉中提取了其他類胡蘿蔔素,這是可以預期的。
葉綠素分析—油樣品
葉綠素也可以在各種植物油中發現,包括橄欖油和菜籽油。對於橄欖油來說,葉綠素及其相關衍生物質使得橄欖油呈現綠色。如圖5所示,一份特級初榨橄欖油樣品的吸收光譜在420 nm、456 nm、484 nm和670 nm處有吸收極大值,且與文獻相符。對於橄欖油來說,吸收主要不是來自於葉綠素a或b,而是主要來自於葉綠素衍生物質,即不含Mg+的葉綠素分子。然而,從圖5中看來,菜籽油在相同光徑長度下的吸收光譜並不相似,這意味著在此實驗中分析的菜籽油已經處理過,將葉綠素去除。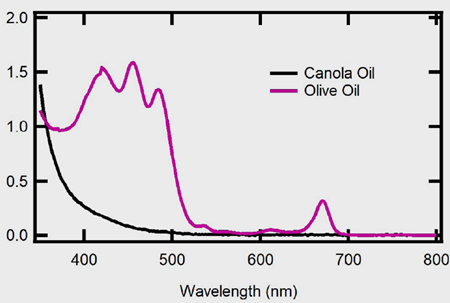
圖5. 菜籽油黑色光譜和橄欖油粉紅色光譜的紫外-可見光光譜
與橄欖油不同,菜籽油中存在葉綠素可能表示產品品質較低,因為當暴露在室溫或陽光下時,葉綠素可能阻礙氫化反應並促進氧化。此外,葉綠素會將產品染成綠色,這是產品不希望看到的。比如菜籽油產品中,仍然需要測定經過精製後產品中葉綠素的含量,以確保產品的品質。AOCS已經制定了一種用於測定精製油中葉綠素含量的光譜法為方法Cc 13d-55,透過在5公分光徑長的比色皿中測量精製油的吸收光譜。
在這裡,使用5公分光徑長的石英比色皿,測量了一份菜籽油樣品的光譜,以根據該方法量化剩餘的葉綠素含量。如圖6所示,正如預期的那樣,在紅色光譜區域中沒有觀察到顯著的特徵。為了確認菜籽油樣品中葉綠素含量很少,採用了AOCS方法Cc 15d-55的修改版本。該程序利用了比爾定律的原則,其中如果知道吸收、消光系數和光路長,就可以確定濃度。正如之前描述的那樣,由於ε取決於溶劑,因此需要實驗確定菜籽油中Chl a的消光係數。
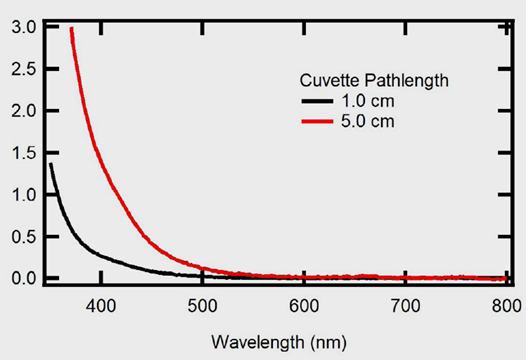
圖6. 不同光徑下的菜籽油紫外-可見光光譜
製作了四個不同的菜籽油樣品,每個樣品都添加了不同濃度的Chl a標準溶液。使用Chl a是因為這是植物產品中最常見的葉綠素形式。每個測量的樣品中的紅色吸收峰值都發現在666 nm。如表5所示,確定在666 nm處的平均ε為0.11 ± 0.01 ppm-1 cm-1。
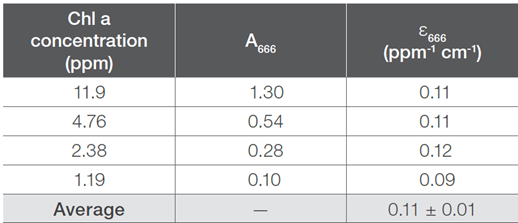
表5. 菜籽油中葉綠素a的吸光度和計算的消光係數。
樣品是在1.0 cm光徑的比色皿中測量。
現在已知ε值,可以使用AOCS方法Cc 13d-55中包含的修改版本的計算方法來量化葉綠素含量。由於吸收峰值從AOCS中概述的670 nm移位到666 nm,因此使用方程式6進行計算。
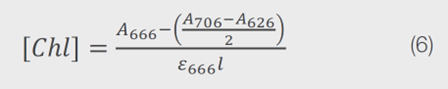
其中[Chl]是以ppm為單位的總葉綠素濃度,A666、A706和A626分別是在666 nm、706 nm和626 nm處測得的吸收度,ε666是在666 nm處的消光係數,而l是所使用的光徑。使用這個方程式6,估算的濃度為0.01 ppm。這個值很低,可以將Chl a的濃度視為可忽略不計。由於這個樣品來自一家超市,預計其中的葉綠素含量很低,因為在商業上可用的菜籽油中,經過精製後其葉綠素含量變很少。


